THIẾT KẾ THỬ NGHIỆM LÂM SÀNG
Bằng chứng về hiệu quả và độ an toàn của thuốc được cung cấp chủ yếu từ các nghiên cứu lâm sàng trong quá trình phát triển thuốc và sau khi đưa thuốc ra thị trường. Trong số các nghiên cứu này, thử nghiệm lâm sàng phân nhóm ngẫu nhiên có kiểm soát (randomized controlled clinical trials), gọi tắt là thử nghiệm lâm sàng, được coi là chuẩn mực để đánh giá hiệu quả của thuốc, cho phép cung cấp bằng chứng tin cậy và có giá trị về
thuốc. Nội dung này sẽ cung cấp cho người đọc khái niệm cơ bản nhất về thiết kế thử nghiệm lâm sàng.
Thử nghiệm lâm sàng là nghiên cứu thực nghiệm, tiến cứu trong đó nghiên cứu viên kiểm soát việc áp dụng các biện pháp can thiệp khác nhau (thuốc/phác đồ điều trị hoặc placebo) trên hai hoặc nhiều nhóm bệnh nhân để đánh giá hiệu quả của các can thiệp này trên các chỉ tiêu lựa chọn. Hơn nữa, bệnh nhân được phân bổ vào các nhóm trong thử nghiệm lâm sàng theo phân nhóm ngẫu nhiên do đó cho phép kiểm soát được nhiều sai số thường gặp trong các nghiên cứu quan sát. Cần lưu ý, do các lý do đạo đức, thử nghiệm lâm sàng không giúp trả lời được tất cả câu hỏi lâm sàng trong thực tế điều trị. Các đặc điểm của thử nghiệm lâm sàng được tóm tắt trong bảng 1.
Bảng 1 Đặc điểm của thiết kế thử nghiệm lâm sàng
| Đặc điểm | Mô tả |
| Mục tiêu | Thiết lập mối quan hệ nhân quả giữa can thiệp (thuốc.phác đồ điều trị) với các chỉ tiêu đánh giá |
| Chiến lược | Đánh giá sự khác biệt trên chỉ tiêu giữa nhóm sử dụng thuốc nghiên cứu với nhóm dùng placebo hoặc thuốc đối chiếu |
| Phân nhóm | Phân nhóm bệnh nhân sử dụng thuốc nghiên cứu hoặc thuốc đối chiếu theo qui trình ngẫu nhiên |
| Ưu điểm | Phân nhóm ngẫu nhiên giúp giảm thiểu sai số Nhóm đối chiếu giúp loại trừ ảnh hường của biến thiên tác dụng theo thời gian Cho phép kiểm soát tốt việc lựa chọn bệnh nhân và thiết kế nghiên cứu do được thực hiện tiến cứu Có thẻ đánh giá đồng thời nhiều can thiệp, trên nhiều chỉ tiêu khác nhau Có thể thiết lập được mối quan hệ nhân quả giữa việc sử dụng thuốc và hiệu quả/ độ an toàn Tuân thủ hướng dẫn CONSORT làm tăng chất lượng của nghiên cứu Có thể sử dụng phân tích gộp để tổng hợp các kết quả khác nhau từ các thử nghiệm lâm sàng khác nhau |
| Hạn chế | Không sử dụng được để đánh giá các tác dụng bất lợi của thuốc Đắt tiền, tốn thời gian và công sức do đó thường có cỡ mẫu nhỏ, tiến hành trong thời gian ngắn, sử dụng các chỉ tiêu gợi ý thay cho chỉ tiêu lâm sàng Bệnh nhân có thể bỏ nghiên cứu làm giảm lợi ích của phân nhóm ngẫu nhiên Bệnh nhân trong nghiên cứu đa trung tâm có thể không tương đồng Cần cân nhắc đến vai trò của các hãng Dược phẩm là nhà tài trợ, người muốn tận dụng sản phẩm đầu ra của nghiên cứu |
Có 2 loại thử nghiệm lâm sàng chính. Thử nghiệm lâm sàng với đối chứng là placebo (placebo controlled trial) nhằm phân biệt hiệu quả của thuốc với tác dụng của giả dược để trả lời câu hỏi liệu thuốc có hiệu quả thực sự hay không và có nên sử dụng thuốc dể điều trị bệnh hay không. Ví dụ simvastatin đã được so sánh với placebo để xác định xem liệu thuốc có làm giảm số trường hợp tử vong ở bệnh nhân có tiền sử đau thắt ngực hoặc nhồi máu cơ tim. Tại thời điểm thử nghiệm lâm sàng này được tiến hành, các bệnh nhân này chưa được sử dụng một cách thường qui statin do đó có thể lựa chọn nhóm đối chứng là placebo. Tuy nhiên, kết quả của thử nghiệm này dù dương tính cũng chưa cho phép xác định dược vị trí của statin trong dự phòng thứ cấp ở những bệnh nhân trên do chưa trả lời được câu hỏi liệu các thuốc khác có khả năng làm giảm nguy cơ trên tốt hơn simvastatin hay không. Trên thực tế, việc thiết kế nhóm đối chiếu placebo càng trở nên khó khăn do thiếu sự tự nguyện sử dụng placebo từ bệnh nhân tham gia nghiên cứu. Loại thử nghiệm lâm sàng thứ hai lựa chọn nhóm đối chứng là thuốc đối chiếu (active controlled trial), cho phép so sánh hiệu quả của thuốc/phác đồ điều trị mới với thuốc/phác đồ điều trị chuẩn hiện tại. Việc lựa chọn thuốc đối chiếu phù hợp (dạng bào chế, liều dùng, vị trí trong phác đồ điều trị) đóng vai trò quan trọng trong đánh giá chất lượng của thử nghiệm lâm sàng và thẩm định kết quả nghiên cứu. Ví dụ trong thử nghiệm COMET, carvedilol được chứng minh là có hiệu quả hơn metoprolol (dạng giải phóng nhanh) trong việc giảm tỷ lệ tử vong ở bệnh nhân suy tim. Tuy nhiên, kết quả của một thử nghiệm lâm sàng khác cho thấy metoprolol (dạng giải phóng có kiểm soát) lại làm giảm tỷ lệ tử vong ở bệnh nhân suy tim tốt hơn placebo. Điều này đặt ra câu hỏi liệu sự vượt trội của carvedilol so với metoprolol trong nghiên cứu COMET có còn được đảm bảo nếu sử dụng thuốc đối chiếu là metoprolol dạng giải phóng có kiểm soát.
Để giảm thiểu sai số, hai kỹ thuật chính được áp dụng trong thử nghiệm lâm sàng là phân nhóm ngẫu nhiên và làm mù. Phân nhóm ngẫu nhiên (randomization) cho phép phân bổ một cách ngẫu nhiên bệnh nhân vào các nhóm điều trị khác nhau do đó cho phép tạo ra sự tương đồng về các yếu tố tiên lượng bệnh chính (đã biết hoặc chưa biết) giữa các nhóm này. Cùng với kỹ thuật làm mù, phân nhóm ngẫu nhiên có vai trò quan trọng trong việc loại trừ các sai số lựa chọn và phân bổ bệnh nhân trong nghiên cứu, giảm thiểu sự khác biệt giữa các nhóm điều trị để cho phép kết luận nếu có sự khác biệt trên chỉ tiêu đánh giá thì nguyên nhân duy nhất là sự khác biệt về thuốc/phác đồ điều trị ở mỗi nhóm tạo nên. Có nhiều kỹ thuật phân nhóm ngẫu nhiên khác nhau: phân nhóm đơn giản dựa vào bảng số ngẫu nhiên, phân nhóm theo block đảm bảo số lượng bệnh nhân tham gia được phân bố đều vào các nhóm điều trị), phân phối theo block phân lớp (đảm bảo các yếu tố tiên lượng quan trọng hoặc các yếu tố nguy cơ được phân bố đều giữa các nhóm điều trị). Làm mù (blinding) giúp hạn chế được các yêu tố sai số do thiên lệch, sự tin tường, chế độ chăm sóc/theo dõi bệnh nhân đến kết quả nghiên cứu, đặc biệt với các nghiên cứu sử dụng chỉ tiêu đánh giá chủ quan (như mức độ đau, thang điểm đánh giá trầm cảm). Một mặt, kỹ thuật này giúp loại bỏ ảnh hưởng của sự lo lắng hay hy vọng của bệnh nhân bằng cách cho bệnh nhân sử dụng cả thuốc nghiên cứu và placebo (dummy) có hình dạng bên ngoài giống nhau để bệnh nhân không biết được mình sử dụng thuốc gì (mù đơn). Mặt khác, kỷ thuật này còn giúp loại bỏ tác động của người làm nghiên cứu (mù đôi) và người xử lý số liệu (mù ba) nếu những người này cũng không được biết về phác đồ điều trị. Nghiên cứu không làm mù được gọi là nghiên cứu nhãn mở (open-label). Trên thực tế, kỹ thuật mù đôi (double-blind) được coi là kỹ thuật làm mù chuẩn mực và nên được áp dụng cho tất cả các thử nghiệm lâm sàng. Trong trường hợp có sự khác biệt về dạng bào chế hoặc số lần đưa thuốc giữa 2 nhóm điều trị, cần áp dụng thêm kỹ thuật double-dummy cho bệnh nhân sử dụng thêm dạng bào chế tương đương có chứa placebo để đảm bảo sự tương đồng giữa hai nhóm. Trong một số trường hợp, vì lý do kỹ thuật (như phẫu thuật) hoặc đạo đức (phác đồ điều trị có nguy cơ cao cho bệnh nhân) thì không thể sử dụng kỹ thuật làm mù cho người làm nghiên cứu.
Về mặt kỹ thuật, có nhiều cách thiết kế thử nghiệm lâm sàng khác nhau.
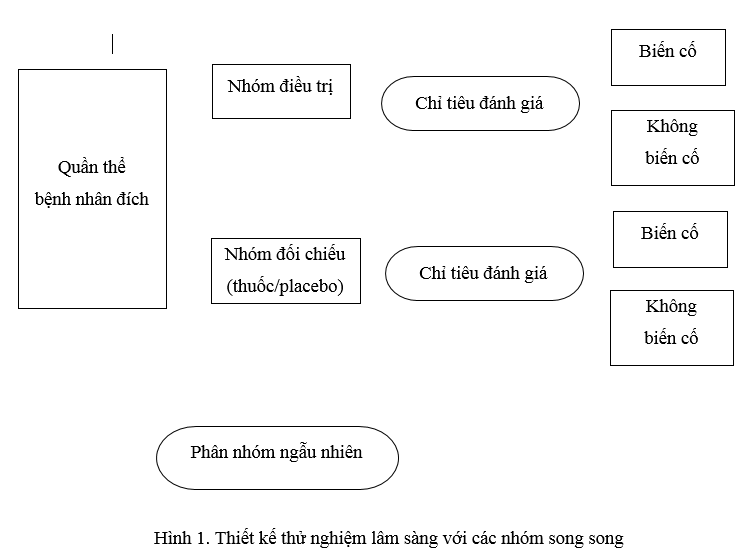
Thiết kế nhóm song song (parallel-groups): đây là cách thiết kế phổ biến nhất trong thử nghiệm lâm sàng để khẳng định hiệu quả của thuốc (pha 3). Bệnh nhân được phân nhóm ngẫu nhiên vào các nhóm điều trị bao gồm thuốc nghiên cứu sử dụng ở một hoặc nhiều mức liều khác nhau song song với 1 hay nhiều nhóm đối chiếu (placebo, thuốc đối chiếu) (hình 1). Cách thiết kế này đặc biệt hữu ích trong trường hợp bệnh lý tiến triển trong thời gian ngắn (như đau nửa đầu, hội chứng ruột kích thích) nhưng cũng được áp dụng trong một số bệnh lý mạn tính như Parkinson, ung thư. Ưu điểm nổi bật của thiết kế này là đơn giản, gần tương tự như điều kiện sử dụng thuốc trong thực tế và tránh được hiệu ứng “carry-over”.
Thiết kế chéo (cross over): trong thiết kế này mỗi bệnh nhân được phân nhóm ngẫu nhiên vào các nhóm điều trị sử dụng thuốc nghiên cứu hoặc thuốc đối chiếu/placebo sau đó một thời gian được chuyển sang sử dụng phác đồ điều trị của nhóm còn lại. Như vậy, mỗi bệnh nhân được sử dụng cả thuốc nghiên cứu và thuốc đối chiếu hoặc placebo và trở thành đối chứng cho chính mình trong nghiên cứu. Thiết kế này loại trừ được sự dao động giữa các cá thể do đó giảm được cỡ mẫu cần thiết của nghiên cứu. Tuy nhiên, hạn chế lớn nhất của thiết kế này là hiệu ứng carry-over, nghĩa là ảnh hưởng tồn dư của can thiệp trước đến giai đoạn sau của nghiên cứu. Để tránh hiệu ứng này, giữa hai lần chuyển đổi can thiệp cần có một khoảng trống (wash-out period) trong đó thời gian phụ thuộc vào bệnh lý và đặc tính dược động học của thuốc nghiên cứu. Thiết kế chéo phù hợp với các bệnh mạn tính như tăng huyết áp, đau thắt ngực ổn định với đặc điểm bệnh lý ổn định trong thời gian tiến hành nghiên cứu.
Thiết kế thừa số (factorial design) với 2 hoặc nhiều thuốc/phác đồ điều trị được đánh giá đồng thời thông qua sự kết hợp khác nhau giữa các phác đồ điều trị này. Thiết kế thừa số đơn giản nhất sử dụng bảng 2x2 trong đó bệnh nhân được phân nhóm ngẫu nhiên vào 1 trong 4 kết hợp của hai thuốc A và B: chỉ dùng thuốc A, chỉ dùng thuốc B, dùng phối hợp A và B và không dùng cả A lẫn B (placebo). Thiết kế thừa số được áp dụng chủ yếu để sử dụng có hiệu quả mẫu bệnh nhân trong đánh giá 2 thuốc/phác đồ điều trị trên cùng số lượng bệnh nhân, thăm dò tương tác giữa thuốc A và thuốc B đồng thời cho phép thiết lập mối tương quan liều lượng-đáp ứng của phối hợp thuốc A và thuốc B khi hiệu quả của từng thuốc riêng lẻ đã được chứng minh trước đó.
Cần lưu ý rằng có hai cách chính để phân tích dữ liệu của thử nghiệm lâm sàng. Cách thứ nhất là phân tích theo dự định điều trị (intention-to-treat, ITT) trong đó dữ liệu của tất cả các bệnh nhân được lựa chọn vào nghiên cứu đều được đưa vào phân tích kể cả trường hợp bệnh nhân không hoàn thành đề cương nghiên cứu (tự rút khỏi nghiên cứu, không tuân thủ phác đồ, tử vong...). Cách phân tích này ước tính chính xác hơn hiệu quả của thuốc nghiên cứu trên quần thể bệnh nhân chung trong đó một số bệnh nhân có thể không luân thủ đúng qui trình điều trị. Ngược lại, cách phân tích thứ hai, phân tích dựa vào đề cương (per-protocol, PP) chỉ phân tích những bệnh nhân đã hoàn thành can thiệp theo đề cương nghiên cứu. Phân tích này cho phép đánh giá chính xác hiệu quả và độ an toàn thực của thuốc nghiên cứu mà không bị làm nhiễu bởi yếu tố không tuân thủ đề cương của bệnh nhân. Một ví dụ về phân tích ITT và PP là thử nghiệm West Scotland trial trong đó phân tích ITT cho thấy pravastatin làm giảm LDL-C 15,8% so với 26,3% với phân tích PP (từ giá trị ban đầu trước điều trị là 190 xuống tương ứng là 160 và 140 mg/dL). Ở nhóm dùng placebo, giá trị LDL-C không thay đổi như đã đự đoán trước đó. Cả kết quả phân tích ITT và PP trong trường hợp này đều có ý nghĩa ứng dụng trong thực hành cho thấy pravastatin có khả năng làm giảm LDL-C 26% ở những bệnh nhân tuân thủ và sử dụng đúng liệu trình điều trị trong khi đó con số này giảm xuống 16% khi xét tổng thể nhóm bệnh nhân sử dụng pravastatin. Như vậy cần lưu ý rằng kết quả thu được qua phân tích PP sẽ bị pha loãng bởi những bệnh nhân không tuân thủ vì nhiều lý do khác nhau như tác đụng không mong muốn hoặc điêu trị không có hiệu quả.
Tài liệu tham khảo
- Hoàng Thị Kim Huyền, J.R.B.J. Brouwers (2014), Những nguyên lý cơ bản và sử dụng thuốc trong điều trị, NXB Y học.
- Hoàng thị Kim Huyền (2010), Chăm sóc dược, NXB Y học.
- Gier JJ de. (1996), The Electronic Pharmaceutical Dossier®; an effective aid in documenting pharmaceutical care data. Pharm World Sci; 18:241-3.